咨询热线
400-810-0881
解析ProteinA与G
提到Protein A和Protein G,相信大家并不陌生,由于它们和抗体的特异性亲和作用,所以可用于纯化抗体,免疫共沉淀实验等,其应用非常广泛,本期小编带大家仔细的认识一下Protein A和G,两者的区别以及如何从中选择。
1. Protein A
20世纪中期,Jensen发现有一种蛋白可以与人和兔血清抗体广泛结合,该蛋白于1964年首次被称为Protein A。 Protein A是一种金黄色葡萄球菌细胞壁蛋白质,分子量42KD,它能够特异性地结合多种免疫球蛋白的Fc区段而与Fab区或轻链结合很弱。天然的Protein A有5个IgG结合结构域和未知功能的非Fc结合域,结构示意图如下:

此结构的蛋白A大量结合IgG的同时,其非Fc结合域能结合部分杂蛋白,导致洗脱下来的IgG纯度不够,因此科学家利用基因工程的方法克隆Protein A的基因并进行改造,得到重组型蛋白A,其非特异性结合明显降低。重组的蛋白A经过改造后有一个C端的半胱氨酸,可以单点偶联到琼脂糖上,降低空间位阻的同时提高IgG的结合能力。一步亲和层析后样品纯度可超过90%。
2. Protein G
蛋白G来自于链球菌G族的细胞表面蛋白,是III型Fc受体,分子量为25KD,其通过类似于蛋白A的非免疫机制而结合抗体的Fc段,蛋白G与蛋白A均可结合抗体的Fc段,不同的是,蛋白G还能结合Fab段,且蛋白G可以更广泛的结合更多类型的IgG分子,多克隆IgG分子,同时蛋白G与血清蛋白结合水平低,产物纯度高,且配基脱落更低。抗体基本结构和蛋白A/G的结合位点如下图所示:
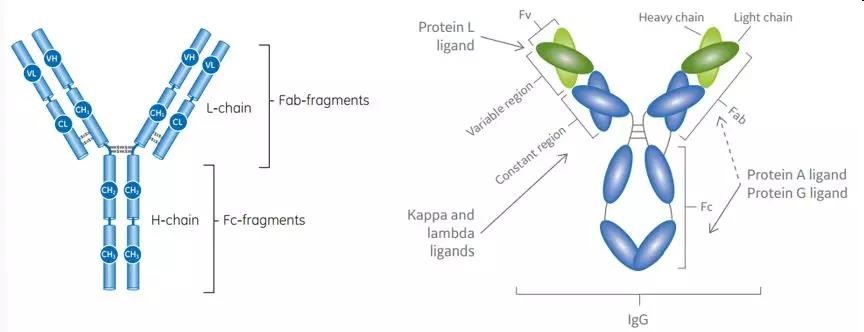
蛋白G可以纯化不能与蛋白A结合的哺乳动物抗体。重组型的蛋白G经改造后已经去除了白蛋白结合位点(血清白蛋白是抗体来源的主要污染物)及细胞表面结合位点,减少了非特异性结合。
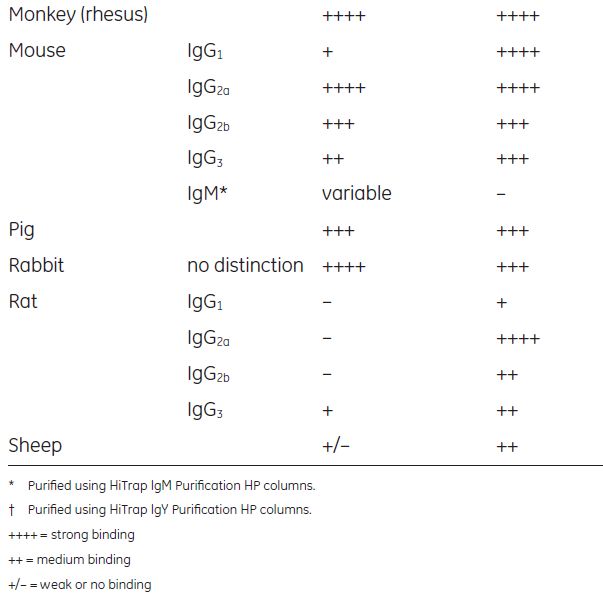
3. Protein A 和G亲和力对比
蛋白A和蛋白G对于不同种属和不同亚型的抗体结合能力差异如下表所示,蛋白A对兔来源抗体的亲和力较高,蛋白G对于小鼠等部分哺乳动物抗体的亲和力较高。
现在对于蛋白A和蛋白G,您是否有了更深入的认识呢?其实我们还有多种抗体亲和材料供选,适合于捕捉各种抗体片段的CaptoL,以及有更好耐碱性的MabSelect SuRe,以及高载量高性能的MabSelect PrismA。
中源生物是GE公司授权的北方区总代理
如有相关问题请拨打免费服务电话咨询
400-8100-881
如您对我们的服务有任何的意见和建议请发至如下邮箱
service@sinozhongyuan.com
 京公网安备11010502040370号 技术支持:青云软件
京公网安备11010502040370号 技术支持:青云软件