咨询热线
400-810-0881
IHC培训第1周:入门
去年9月份的时候,小编推荐了Abcam的WB新手入门课程(每周一节,共分4节),不知道小伙伴们有没有get到WB的全套技能呢?现在,Abcam推出了实验必备的升级技能---IHC,同样是以每周一次课程的形式。跟着小编学起来吧!
在第 1周的 IHC 培训中,我们将展示如何开启一个良好的开端。如何制备样本将会成为决定最终数据质量的重要影响因素。本次培训中,我们将指导您完成 IHC 最佳样本处理的主要步骤。
1、什么是免疫组化?
免疫组化(immunohistochemistry,IHC)是利用抗原-抗体相互作用显示组织切片中抗原分布和定位的一种方法。
IHC 常用于诊断癌症等疾病中的异常细胞和组织。总体而言,IHC 提供了有价值的观点和支持,使其他方法获得的数据更加有据可依。
IHC 染色依赖于识别靶蛋白的抗体,可以通过两种检测方法对抗原-抗体的相互作用进行可视化,一种是显色方法(酶偶联抗体催化底物显色,产生有色沉淀);另一种是荧光检测法(荧光基团偶联抗体产生荧光)。
2、标本形式
IHC组织保存的两种主要方法是石蜡包埋和组织冰冻(总结如下):
| IHC-石蜡包埋 | IHC-组织冰冻 | |
| 切片厚度 | 4-5 µm | 4-10 µm |
| 固定 |
最常用10%中性福尔马林缓冲液 (neutral-buffered formalin, NBF) 预包埋 |
切片前或切片后,多聚甲醛、丙酮或丙酮: 乙醇 1:1 溶液 |
| 切片 | 切片机 | 冰冻机 |
| 储存 | 室温下储存数年(抗原可能随时间变化) | -80℃ 下储存 1 年(-190℃ 下保存时间更长) |
| 优点 |
- 形态结构保存与抗原性的最佳平衡; - 非常稳定且易于使用; |
- 抗原处于更“天然”的状态; - 适用于不耐受标准醛固定和石蜡处理的抗原; - 适用于磷酸化抗原表位; |
| 缺点 |
- 过度固定(超过 24 小时)可掩盖抗原表位; - 免疫染色前需要脱蜡; - 使用交联 [醛] 试剂固定需要进行抗原修复; |
- 如果形成冰晶,形态保存可能比石蜡切片差; - 切片过厚会导致图像分辨率较低,图片拍摄效果较差; - 样本易碎; |
3、固定
固定可防止离体组织自溶和坏死,保留抗原特性,提高组织成分的折射率,同时有助于保护样本处理过程中的细胞成分。靶抗原和所需的检测技术都会影响固定剂的选择,如下图所示。
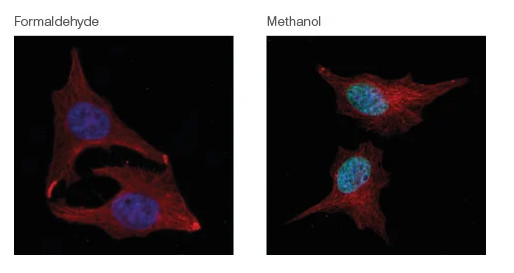
图 1:固定剂对免疫染色效果的影响。和甲醛固定(左)相比,用甲醇固定的 HeLa 细胞(右)中更易检出组蛋白 H2B K5 巴豆酰化免疫组化结果。一抗:ab177139,组蛋白 H2B(K5巴豆酰化)的兔多克隆抗体,1 μg/mL。二抗:ab150081,山羊抗兔 IgG H&L (Alexa Fluor® 488),0.5 μg/mL。DAPI 染核, ab7291 搭配ab150120 染微管蛋白(红色)。
以下是我们关于固定剂选择的建议:
· 大多数低分子量的蛋白质、多肽和酶:对于细胞/细胞学样本制备,使用 4% 甲醛;对于组织切片,使用 10% 中性福尔马林缓冲(NBF)液;
· 柔软精细组织:Bouin 固定液;
· 氨基酸等小分子:4% 甲醛;
· 造血器官(如肝、脾、骨髓):Zenker 固定液;
· 结缔组织:Helly 固定液;
· 核酸:Carnoy 固定液;
· 大分子蛋白抗原(如免疫球蛋白):冰浴丙酮或甲醇(100%);
· 细胞核形态:福尔马林-硫酸锌溶液;
· 电镜成像:4% 甲醛,1% 戊二醛溶液。
4、包埋和切片
固定组织后需立即处理,以充分保证组织被切成厚度为 4-5 μm 。组织经脱水、透明化,然后浸蜡,以进行切片。本方案包括
· 石蜡组织处理
· 冰冻组织包埋
· 乙二醇甲基丙烯酸酯 (Glycol methacrylate, GMA) 包埋
小结
希望您现在已经具备良好的前期基础,可以开始计划您的 IHC 实验。您应该对样本制备有更多了解,尤其是:IHC 样本保存的两种主要方法,以及组织固定和包埋方法。
下周我们将介绍免疫组化染色原理以及抗原修复、通透化和封闭。
本文内容来源于abcam官网。
中源生物是Abcam公司授权的一级代理商
如有相关问题请拨打免费服务电话咨询
400-8100-881
如您对我们的服务有任何的意见和建议请发至如下邮箱
service@sinozhongyuan.com
 京公网安备11010502040370号 技术支持:青云软件
京公网安备11010502040370号 技术支持:青云软件