咨询热线
400-810-0881
官方“自噬”实验操作指南(一)
自噬是一个多步骤的动态过程,这就为其定量检测带来困难。传统方法利用电子显微镜对自噬过程进行研究。自噬相关蛋白的发现和表征促进了鉴别和量化自噬活性的分子工具和方法的发展。理想情况下,应该使用组合测量方法,使用包括稳态和自噬流测定等来评估不同体系的自噬活动。
这是一份来自官方的检测操作指南,重要性你懂得~
稳态分析实验:自噬小体数量
自噬小体的数量分析实验通常测定的是LC3蛋白。LC3存在于胞质和核室中。脂化型或LC3 - II是已知的唯一与自噬小体内膜相关的蛋白。免疫荧(ICC/IHC/IF)和免疫印记(WB)可以检测LC3-II水平,通过它可以较好地评估自噬小体的数量。有超过500篇文献显示:我们的LC3B抗体(产品编号#NB100-2220)是被广泛信任和使用的可以检测LC3水平的抗体。
LC3-II 斑点实验(ICC /IHC/ IF)
该方法结合使用LC3抗体与荧光显微镜来定量检测荧光斑点,这些斑点的数量和自噬小体的数量相关。这个实验可以得知每个细胞的斑点数或有斑点的细胞数量。然而,在大多数细胞均有基础的自噬活动,因此大多数细胞将会有斑点出现。
实验方案:通过LC3免疫细胞化学实验检测自噬小体数量

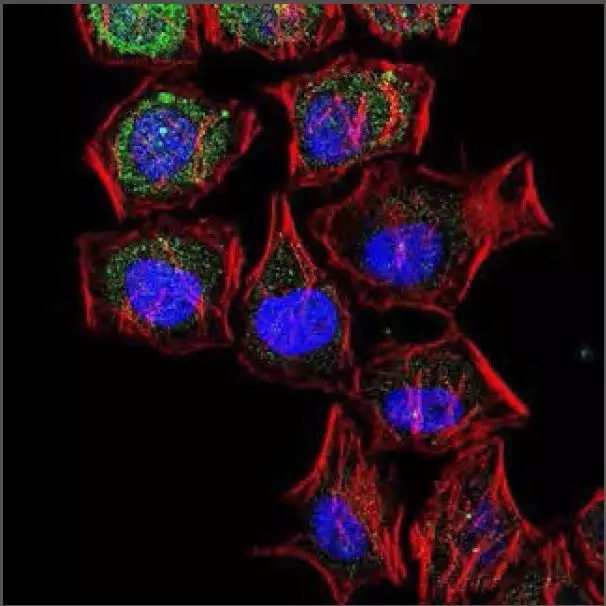
免疫细胞化学/免疫荧光:共聚焦分析Hela-细胞,使用的是LC3B抗体(产品编号 #NB600–1384, 1:5000)。采用Alexa Fluor 488-结合的山羊抗兔IgG作为二抗(绿色)。肌动蛋白被标记为Alexa Fluor 568 Phalloidin(红色)。DAPI用于染细胞核(蓝色)
LC3-转化 (免疫印迹法)
该方法测量LC3的转化,从未脂化的LC3-I到脂化的LC3 - II型。转化率的增加与自噬小体的数量增加有关。量化应该基于LC3 - II水平与内参蛋白(如ACTIN)水平的比较。然而,在某些系统中,内参蛋白的水平受到自噬的影响,此时LC3-I可被用来作比较。

自噬流监测
自噬流牵涉到细胞内物质的整个变化过程,从分离到降解,再将基本组分回收到胞质的整个过程。
LC3转变分析(WB, ICC/IF)
这一检测方法可以监测自噬小体的累积,以确定自噬流。用溶酶体药物和蛋白酶抑制剂可以阻断自噬流和LC3-II的降解。用有无这些试剂时LC3-II的数量差异来反映自噬流的变化。这一实验使研究人员能够区分真实的自噬诱导和自噬流的阻断。
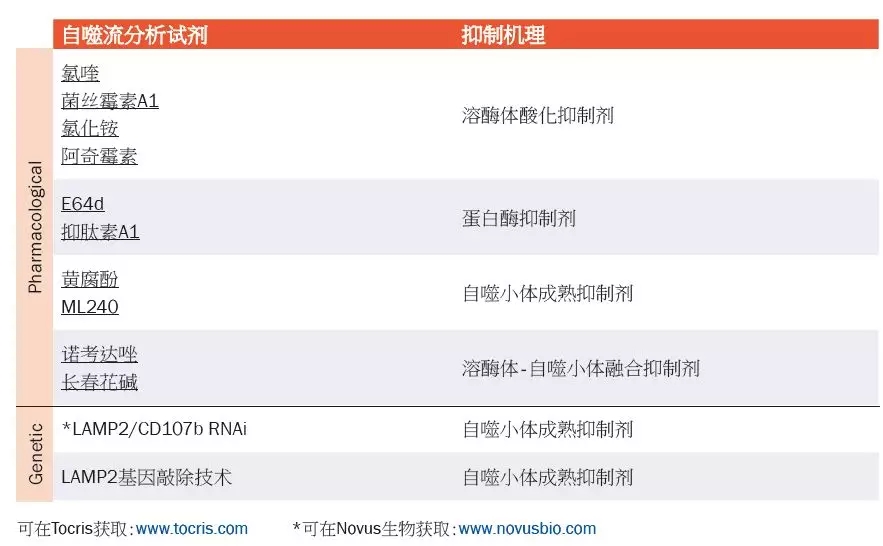
实验方案:Western Blot检测LC3-II转变实验

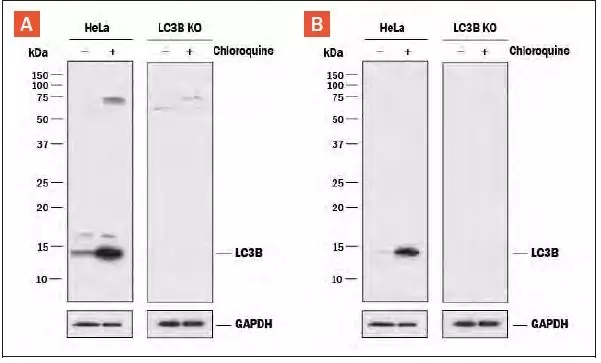
Hela人类宫颈上皮癌敏感细胞系和LC3B敲除的Hela细胞系,不处理或50μM氯喹处理18h。全细胞蛋白裂解物在1×Laemmli的样品缓冲液中溶解,以每个裂解物10μg上样至4-15%SDS- PAGE凝胶分离蛋白,转膜至0.2 μm 的PVDF膜,用含5%的脱脂奶粉的TBST封闭液来封闭。 PVDF膜用(A)兔抗LC3B多克隆抗体(产品编号#NB100-2220)和(B)兔抗LC3B单克隆抗体 (产品编号#NBP2-46892)作为一抗,二抗为HRP-标记的抗兔IgG。在亲本Hela细胞系中,特异的LC3B条带在约15kDa(如图所示),但在LC3B敲除的Hela细胞系中检测不到。GAPDH为内参蛋白。此实验条件被简化过。

以上文字、图片来源于:Bio-techne
北京中原公司是Bio-Techne公司旗下
R&D Systems、Novus、Tocris品牌的一级代理商
如有相关问题请拨打免费服务电话咨询
400-8100-881
如您对我们的服务有任何的意见和建议请发至如下邮箱
service@sinozhongyuan.com
 京公网安备11010502040370号 技术支持:青云软件
京公网安备11010502040370号 技术支持:青云软件