咨询热线
400-810-0881
【科普】PD-1和PD-L1的前世今生
本文部分内容来源于生物谷
2015年12月,美国第39届总统吉米·卡特在接受靶向放疗和免疫抗癌新药KEYTRUDA治疗后发表声明说,医生在给他做完最近一次脑部磁力共振扫瞄后,没有发现此前在他大脑中出现的黑色素瘤(Melanoma)或新的癌细胞,这成功引起广泛关注同时彰显了PD-1免疫疗法在肿瘤治疗方面的潜力。本文旨在为大家介绍PD-1及最新研究进展。
PD-1、PD-L1和PD-1免疫疗法
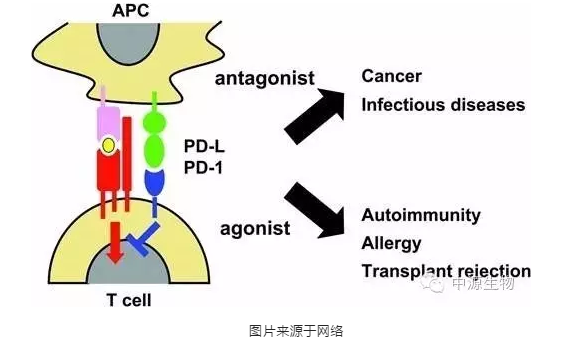
PD-1(programmed death 1)程序性死亡受体-1:是一种重要的免疫抑制分子。为CD28超家族成员,其最初是从凋亡的小鼠T细胞杂交瘤2B4.11克隆出来。以PD-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义。
PD-1是通过解除肿瘤逃避免疫系统能力的新型免疫疗法。癌细胞逃避摧毁的一种方法,是通过在它的表面产生一种称为程序性死亡配体-1(PD-L1),这种PD-L1联接到一类免疫细胞T细胞的PD-1蛋白上。当PD-L1与PD-1联接以后,T细胞就不能够发现肿瘤和向免疫系统发出攻击肿瘤的信号。该免疫疗法的设计思路是,给予肿瘤患者针对PD-1或PD-L1的一种抗体蛋白质,将使前两种蛋白质不会联接,T细胞的功能也不会关停—美国已经有抗PD-1药物的临床试验,证实了这一策略,证明这种机理治疗癌症的成效显著。
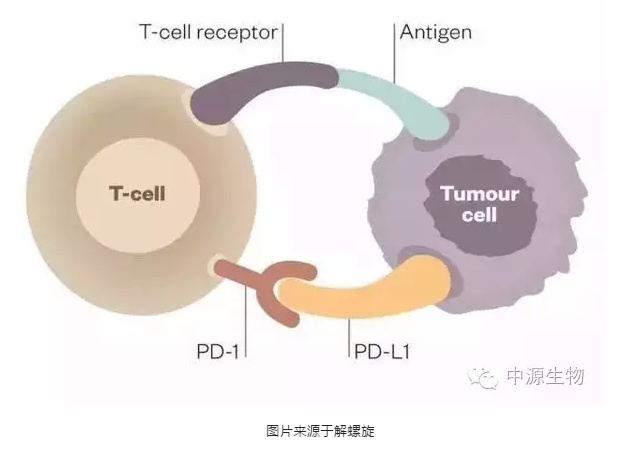
肿瘤细胞逃避T细胞摧毁的一种途径是通过在它表面产生PD-L1,当免疫细胞T细胞表面的PD-1识别PD-L1后,可以传导抑制行信号,T细胞就不能发现肿瘤细胞和向肿瘤细胞发出攻击信号。
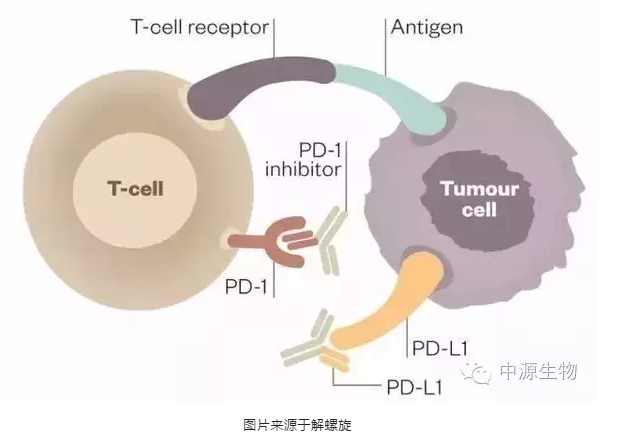
PD-1是通过解除肿瘤细胞逃避免疫系统的新型免疫疗法。PD-1免疫疗法的作用机制是针对PD-1或PD-L1设计特定的蛋白质抗体,阻止PD-1和PD-L1的识别过程,部分恢复T细胞功能,从而使T细胞可以杀死肿瘤细胞。
全球商业情报机构GBI发布的数据显示,预计到2022年,全球免疫治疗市场规模将从2015年的615亿美元扩大至742亿美元,或将占据肿瘤治疗的半壁江山。
就国内市场而言,专家估计三年内将达到几百亿的市场规模。如此诱人的医疗价值和商业前景,各大制药巨头纷纷致力于PD-1抗体药物的研究,并取得一定的进展。
PD-1免疫疗法最新研究结果如下
1. Keytruda(pembrolizumab)可诱导高级别默克尔细胞癌的高反应性
美国时间2014年9月5日,全球医疗行业巨头默沙东宣布,治疗癌症新药Keytruda(pembrolizumab)已经获得美国食品和药物管理局(FDA)批准。这款药物主要用于接受ipilimumab(伊匹单抗)疗法后的不可切除性或转移性黑色素瘤患者的治疗,据了解,Keytruda是在美国获批的首个抗PD-1药物,且获得了FDA的“突破性治疗药物”资格。
在2016AACR年会上,华盛顿大学医学院皮肤病学科教授Paul T. Nghiem,MD,PhD做出报道,pembrolizumab这一具有抗PD-1作用的单克隆抗体可诱导高级别默克尔细胞癌的高反应性,中位无进展生存期 PFS是9个月,传统化疗的患者PFS是3个月。默克尔细胞癌是一种侵袭性皮肤癌,美国每年大约2000人会受到紫外线暴露和默克尔细胞多瘤病毒的影响,其中超过40%的患者会进一步发展为高级别肿瘤。目前尚没有FDA批准的治疗方法,一线治疗包括铂类+依托泊苷,尽管患者应答率只有55%,但很少发生耐药。
研究发现有超过一半的肿瘤细胞表达PD-L1,默克尔细胞多瘤病毒特异性T细胞在超过2/3的患者中表达 PD-1,这意味着通过PD-1免疫疗法可以提高默尔克细胞癌患者的生存率。
2. Opdivo+Yervoy组合疗法黑色素瘤临床试验效果显着
2015年6月22日,美国FDA同意审评百时美施贵宝PD-1抑制剂OPDIVO(nivolumab)纳武单抗作为一款治疗药物用于先前有过治疗的晚期鳞状非小细胞肺癌(NSCLC) 患者。FDA还表示,它将以优先审评程序对这款药物的上市申请予以审评。Opdivo纳武单抗在获批用于晚期鳞状非小细胞肺癌、成为首款免疫治疗药物之后,其将拥有良好的机会。

近日百时美PD-1抑制剂Opdivo在临床试验方面取得新进展,百时美公司发布了两组数据,其中一组显示,对当前任何药物均无治疗反应的晚期黑色素瘤的患者在使用Opdivo治疗中取得了34%五年生存率的结果。值得注意的是,IV期黑色素瘤患者的五年生存率通常只有15%到20%。另一组数据表明Opdivo和Yervoy联用治疗晚期黑色素瘤患者中取得22%的总缓解率,并且达到了69%两年总体生存率。
这一临床试验结果意味着接受Yervoy治疗的黑色素瘤患者将获得三年的生存期,而接受Opdivo治疗的患者生存期将会达到四年,并且可能不会复发。在使用免疫检查点抑制剂后,患者的免疫系统可以控制甚至完全清除肿瘤。
3. FDA批准膀胱癌靶向治疗新药Tecentriq
美国FDA在2016年5月18日批准了Roche公司的Tecentriq(atezolizumab)用于治疗尿路上皮癌,这是首个获准治疗这类癌症的PD-1/PD-L1抑制剂类新药。Tecentriq靶向阻断PD-1/PD-L1通路,有助于人体免疫系统攻击肿瘤细胞。Tecentriq是FDA批准的首个PD-L1抑制剂,也是近两年批准的最新PD-1/PD-L1靶向生物制剂。
Tecentriq获准用于治疗含铂类药物化疗治疗期间或治疗后疾病恶化,或者术前(新辅助治疗)或术后(辅助治疗)接受含铂类药物化疗12个月内疾病恶化的局部晚期或转移性尿路上皮癌患者。尿路上皮癌是最常见的膀胱癌类型,发生于尿路系统,累及膀胱及其相关器官。Tecentriq的安全性和有效性透过一项纳入310例局部晚期或转移性尿路上皮癌的单臂临床研究进行了评价。总体上,肿瘤出现全部或部分缩小的患者比例(客观应答率)为14.8%,该作用可持续2.1~13.8个月。PD-L1表达阳性患者,应答率提高至26%,这表明PD-L1表达水平有助于医生识别哪些患者可能从Tecentriq治疗中获益更大。
PD-1免疫疗法的市场前景巨大
PD-1/PD-L1药物是当前备受瞩目的新一类肿瘤疗法,更是免疫治疗中的主力军。全球商业情报机构GBI发布的数据显示,预计到2022年,全球免疫治疗市场规模将从2015年的615亿美元扩大至742亿美元,或将占据肿瘤治疗的半壁江山。就国内而言,专家估计三年内将达到几百亿的市场规模。
据汤森路透Cortellis数据库预计,BMS的Nivolumab和默沙东的Pembrolizumab到2020年的销售额将分别达到60.46亿美元和39.22亿美元。此外,有机构预测2020年,罗氏的Atezolizumab销售额将达15.0亿美元;阿斯利康的Durvalumab销售额将达为12.0亿美元。4个产品销售额总计超过百亿美元。
 京公网安备11010502040370号 技术支持:青云软件
京公网安备11010502040370号 技术支持:青云软件